Une Révolution Discrète dans les Tests de Médicaments : La Rupture de la FDA avec les Modèles Animaux Promet un Pipeline Biopharmaceutique Plus Rapide, Moins Cher et Plus Éthique
L'Agence américaine des produits alimentaires et médicamenteux (FDA) a annoncé aujourd'hui son intention de supprimer progressivement les tests obligatoires sur les animaux pour les anticorps monoclonaux et autres médicaments. Cette décision, préparée depuis des années et longtemps réclamée par les défenseurs de l'éthique et les scientifiques cliniques, amorce une transition radicale vers des méthodes d'évaluation de la sécurité et de l'efficacité des médicaments plus prédictives, efficaces et pertinentes pour l'être humain.

"C'est la fin d'une hypothèse scientifique vieille d'un siècle", a déclaré un analyste réglementaire connaissant bien le processus. "Nous abandonnons les modèles animaux et entrons dans le domaine de la biologie computationnelle et des systèmes humains artificiels. Les implications sont considérables."
Du Laboratoire Animal à la Puce Électronique : La Feuille de Route Innovante de la FDA
Une Nouvelle Ère de Toxicologie
La feuille de route récemment dévoilée par la FDA décrit l'utilisation des Nouvelles Méthodologies d'Approche (NMA) - un ensemble d'outils allant des modèles computationnels basés sur l'IA aux organoïdes dérivés de l'homme et aux technologies d'organes sur puce. Ces outils visent à reproduire la biologie humaine avec une fidélité bien supérieure à la norme actuelle : les tests sur les animaux.
Les Nouvelles Méthodologies d'Approche (NMA) désignent diverses techniques modernes utilisées principalement dans le domaine de la toxicologie et de l'évaluation de la sécurité. Elles englobent des méthodes in vitro, in silico et d'autres méthodes non animales, développées comme alternatives pour remplacer, réduire ou améliorer les procédures traditionnelles de tests sur les animaux.
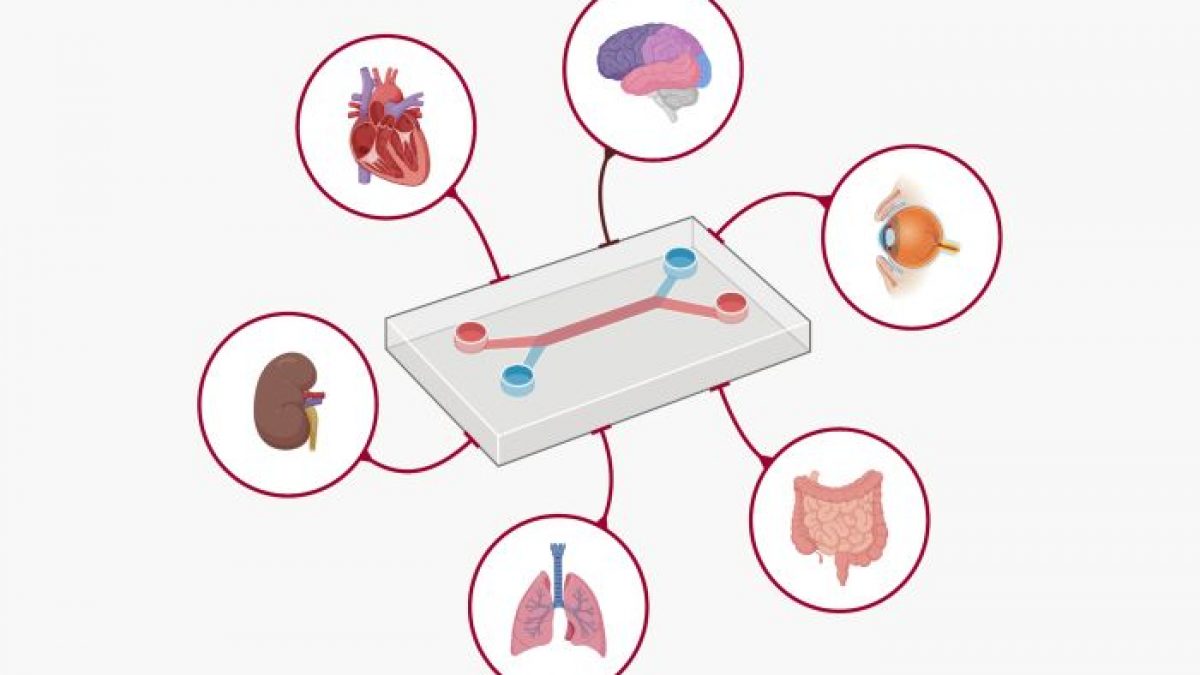
Les principaux éléments de cette politique sont les suivants :
- Encouragement immédiat des données NMA dans les demandes d'autorisation de nouveaux médicaments expérimentaux (IND).
- Acceptation des données de sécurité humaine réelles provenant d'organismes de réglementation internationaux comparables.
- Programmes pilotes commençant cette année, permettant à certains développeurs de soumettre des anticorps monoclonaux évalués principalement par des méthodes non animales.
- Incitations réglementaires, y compris des examens simplifiés, pour les développeurs qui présentent des données de tests non animales validées.
"C'est une situation gagnant-gagnant", a déclaré un toxicologue principal. "Les médicaments parviennent plus rapidement aux patients. Les coûts de développement sont moins élevés. Et nous nous éloignons des modèles animaux, éthiquement problématiques et souvent peu prédictifs."
Le Statu Quo : Défectueux, Coûteux et Éthiquement Douteux
Les Coûts Cachés des Tests sur les Animaux
Pendant des décennies, les tests sur les animaux ont été la référence absolue en matière de réglementation. Des souris et des rats aux chiens et aux primates, les animaux ont été utilisés pour simuler les réponses humaines aux médicaments expérimentaux. Mais ces modèles sont souvent insuffisants. Une molécule qui fonctionne bien chez un rongeur peut se comporter de manière imprévisible chez l'homme - un fossé translationnel qui a contribué à d'innombrables échecs d'essais cliniques en phase tardive et à des retraits de sécurité après l'approbation.

| Mesure | Statistique/Résultat | Source/Contexte |
|---|---|---|
| Taux d'échec global des essais cliniques (post-tests précliniques) | Environ 90 % à 92 % des médicaments candidats qui entrent dans les essais cliniques sur l'homme n'obtiennent pas l'approbation réglementaire. | De nombreuses sources citent cette fourchette, notamment BIO, Cruelty Free International et des articles universitaires faisant référence aux données de l'industrie (par exemple, Sun et al., 2022). |
| Principales raisons de l'échec des essais cliniques | Manque d'efficacité clinique (40-50 %), problèmes de toxicité/sécurité ingérables (environ 30 %), mauvaises propriétés médicamenteuses (10-15 %). | Analyse citée dans Sun et al. (2022) et corroborée par des conclusions selon lesquelles plus de la moitié des échecs de phase II/III sont dus à un manque d'efficacité. |
| Prédictibilité des modèles animaux | Des taux d'échec élevés chez l'homme (par exemple, 92 %) se produisent malgré des résultats prometteurs lors des tests précliniques, y compris les tests sur les animaux. | Cruelty Free International, PETA, Humane Society International et des revues universitaires soulignent le décalage (fossé translationnel). |
| Taux de réussite par phase clinique (données d'environ 2011-2020) | Phase I : ~52 % de réussite ; Phase II : ~29 % de réussite ; Phase III : ~58 % de réussite. | Les données rapportées par BIO (Biotechnology Innovation Organisation) indiquent que la phase II est un goulot d'étranglement majeur. |
| Taux d'échec par domaine thérapeutique (données d'environ 2011-2020, entrant dans les essais) | Urologie (~96 % d'échec), Cardiologie (~95 % d'échec), Oncologie (~95 % d'échec), Neurologie (~94 % d'échec). | Les données rapportées par BIO montrent des taux d'échec très élevés dans différents domaines pathologiques. |
Le "fossé translationnel" dans le développement de médicaments fait référence à la difficulté importante et au taux d'échec élevé rencontrés lors de la tentative de traduire des découvertes scientifiques fondamentales prometteuses du laboratoire ("banc") en traitements efficaces et sûrs pour les patients humains ("chevet"). Un défi majeur est que les modèles précliniques, en particulier les études sur les animaux, ne parviennent souvent pas à prédire avec précision comment un médicament potentiel se comportera chez l'homme.
De plus, les tests sur les animaux sont notoirement coûteux et lents. On estime qu'ils peuvent ajouter des mois, voire des années au calendrier de développement et gonfler les coûts de R&D de centaines de millions de dollars.
Tableau : Comparaison des coûts et des délais pour les tests traditionnels sur les animaux et les NMA dans le développement préclinique de médicaments
| Aspect | Tests traditionnels sur les animaux | Nouvelles méthodologies alternatives (NMA) |
|---|---|---|
| Coût | 2 à 4 millions de dollars par étude ; forte variabilité | Coûts inférieurs grâce à l'automatisation et à l'efficacité |
| Délai | 4 à 10 ans pour des études complètes | Résultats rapides (de quelques semaines à quelques mois) |
| Efficacité | Valeur prédictive limitée pour la biologie humaine | Débit élevé et pertinence humaine |
| Défis | Nécessaire pour les évaluations complexes et à long terme ; exigences réglementaires | Ne peut pas reproduire entièrement les systèmes complexes ; adoption réglementaire limitée |
Il y a ensuite le calcul éthique. Chaque année, des dizaines de milliers d'animaux sont utilisés dans le développement de médicaments aux États-Unis. Beaucoup de ces expériences impliquent des procédures invasives sans possibilité de récupération. Dans cette optique, la décision de la FDA n'est pas seulement un bond scientifique, mais un point d'inflexion éthique.
Tests Pertinents pour l'Homme : La Précision Sans la Douleur
Les Modèles d'IA et les Organoïdes Prennent le Centre de la Scène
Qu'est-ce qui remplace l'ancien modèle ? Une puissante convergence de technologies autrefois considérées comme futuristes :
-
Toxicologie de l'Intelligence Artificielle : Les outils d'IA entraînés sur des millions de points de données peuvent désormais simuler le comportement des médicaments dans les tissus humains, en prédisant les effets secondaires et la toxicité des organes avec une précision croissante. Certains modèles peuvent cartographier la distribution des anticorps monoclonaux dans le corps humain in silico - sans un seul animal de laboratoire.
-
Organoïdes et Systèmes Organe-sur-Puce : Ces tissus humains cultivés en laboratoire - de minuscules versions d'organes comme le foie, le cœur ou le système immunitaire - offrent une fenêtre directe sur la biologie humaine. Les chercheurs peuvent désormais observer en temps réel comment les médicaments affectent les cellules humaines réelles.
Un des premiers utilisateurs dans une entreprise de biotechnologie de taille moyenne a noté : "Dans notre récent programme d'anticorps monoclonaux, les modèles d'organoïdes ont détecté une hépatotoxicité que nos modèles de rats avaient complètement manquée. Ce n'est pas seulement de l'efficacité. C'est la sécurité des patients."
Qui Gagne, Qui Perd : Une Industrie Rééquilibrée
Gagnants : Les Innovateurs Propulsés par la Technologie et les Biotechs Agiles
Pour les entreprises qui investissent depuis longtemps dans les tests pertinents pour l'homme, la décision de la FDA est une justification - et un vent arrière évident. Ceux-ci inclus:
- Les biotechs utilisant des systèmes organoïdes et in vitro, capables de réduire leurs délais précliniques jusqu'à 40 %.
- Les développeurs de plateformes d'IA, construisant des modèles de toxicologie prédictive que les grandes entreprises pharmaceutiques s'empressent désormais de licencier.
- Les Organisations de Recherche Contractuelle (ORC) qui sont passées tôt des tests sur les animaux aux tests cellulaires et aux simulations sur silicium.

Les investisseurs l'ont déjà remarqué. "Nous considérons cela comme un vent arrière séculaire de cinq ans pour tout acteur impliqué dans les tests alternatifs", a déclaré un gestionnaire de portefeuille d'un fonds spéculatif axé sur les sciences de la vie.
Perdants : Les Entreprises Traditionnelles de Tests sur les Animaux Menacées
L'impact sur les ORC traditionnelles de tests sur les animaux est plus sombre. Des rapports indiquent une baisse de 28 % des actions de Charles River Laboratories, un baromètre de l'industrie des tests sur les animaux, suite à l'annonce de la FDA. Ces entreprises sont désormais confrontées à un choix radical : se transformer ou disparaître.
Graphique de l'évolution récente du cours de l'action de Charles River Laboratories (CRL).
| Date | Cours d'ouverture (USD) | Cours le plus élevé (USD) | Cours le plus bas (USD) | Cours de clôture (USD) | Volume |
|---|---|---|---|---|---|
| 2025-04-09 | 121,71 | 139,31 | 117,26 | 139,07 | 1 974 894 |
| 2025-04-08 | 136,86 | 137,96 | 122,06 | 123,61 | 1 586 299 |
| 2025-04-07 | 132,79 | 139,16 | 128,03 | 134,07 | 1 984 859 |
"C'est comme la transition du film au numérique en photographie", a déclaré un analyste. "Sauf que cette fois, les enjeux se chiffrent en milliards de dollars de revenus de R&D."
La Voie à Suivre : Validation, Transition et Résistance
Coordination Réglementaire et Implications Mondiales
Bien que la feuille de route offre de la clarté, la transition est loin d'être terminée. Un défi essentiel sera la validation - prouver que ces nouvelles méthodes prédisent les résultats humains mieux que les animaux, de manière cohérente et pour tous les types de médicaments.
La validation des Nouvelles Méthodologies d'Approche (NMA) fait référence au processus consistant à établir leur fiabilité et leur pertinence scientifiques pour un objectif spécifique, tel que les tests de toxicité. Cela implique généralement le respect de critères scientifiques définis et de processus formels, souvent guidés par des organismes de réglementation comme la FDA, pour s'assurer que la méthode alternative est adaptée à son objectif.
La FDA, en partenariat avec les NIH, le Programme National de Toxicologie et le Département des Affaires des Anciens Combattants, organise un atelier public plus tard cette année. Elle sollicitera des commentaires et affinera les calendriers de mise en œuvre. Un programme pilote lancé cette année testera la feuille de route dans des conditions réelles, ce qui façonnera probablement des orientations plus larges en 2026 et au-delà.
D'autres organismes de réglementation suivent de près. Si l'initiative de la FDA réussit, une harmonisation mondiale pourrait suivre, les organismes de réglementation européens, canadiens et asiatiques pouvant adopter des normes alignées - un changement qui rationaliserait considérablement le développement international de médicaments.
Analyse de Marché : Risque, Rotation et Récompense
La Thèse d'Investissement Biopharmaceutique au Lendemain des Bouleversements Réglementaires
Du point de vue des marchés financiers, la décision de la FDA est l'un des changements réglementaires les plus importants des dernières décennies.
- Les modèles de R&D biopharmaceutique seront compressés, les délais étant réduits de plusieurs mois, voire de plusieurs années.
- Les marges bénéficiaires pourraient augmenter à mesure que les entreprises réduisent les coûts associés aux longs cycles de tests sur les animaux et aux protocoles de sécurité redondants.
- L'activité de fusions et acquisitions devrait augmenter, les ORC expertes en technologie et les entreprises de modélisation de l'IA devenant des cibles attrayantes.
Croissance projetée du marché des Nouvelles Méthodologies d'Approche (NMA) par rapport aux prévisions du marché traditionnel des tests sur les animaux.
| Segment de marché | Région/Portée | Valeur de l'année de base (approx.) | Valeur projetée (approx.) | TCAC (approx.) | Période de prévision | Notes de source |
|---|---|---|---|---|---|---|
| Tests alternatifs non animaux (NMA) | Mondial | 1,11 milliard USD (2019) | - | 6,34 % | 2023-2028 | Divers rapports indiquent une croissance importante, stimulée par les préoccupations éthiques et les pressions réglementaires (par exemple, les principes des 3R). Comprend les méthodes in vitro, in silico et organe-sur-puce. |
| Tests alternatifs non animaux (NMA) | Mondial | 9,8 milliards USD (2021) | 29,4 milliards USD (2030) | 13,5 % | 2022-2030 | Une autre prévision montrant une croissance encore plus forte, incluant potentiellement une définition plus large des NMA ou une portée de marché différente. Souligne le soutien du gouvernement et des technologies comme les organes-sur-puce. |
| Tests alternatifs non animaux (NMA) | Mondial | 1,8 milliard USD (2023) | - | 11,9 % | 2024-2032 | Met en évidence les investissements croissants, les préoccupations éthiques, le soutien réglementaire (FDA/UE) et les avancées technologiques (organe-sur-puce, modèles tissulaires 3D) comme principaux moteurs. |
| Tests de toxicologie in vitro (composante des NMA) | Mondial | 10,99 milliards USD (2023) | 30,06 milliards USD (2033) | 10,82 % | 2024-2033 | Représente une part importante du marché des NMA, affichant une forte croissance stimulée par la découverte de médicaments, la sécurité chimique et l'acceptation réglementaire. De multiples sources affichent des TCAC similaires (10,8 %-11,2 %). |
| Marché des organoïdes (technologie NMA spécifique) | Mondial | - | 3,3 milliards USD (2027) | 21,7 % | Les 3 prochaines années | Technologie NMA spécifique affichant un potentiel de croissance très élevé, reflétant les progrès de la modélisation biologique complexe. |
| Tests traditionnels sur les animaux | Mondial | 10,74 milliards USD (2019) | - | 1,03 % | 2023-2028 | Affiche une croissance significativement plus lente que les NMA, attribuée aux pressions éthiques, à l'adoption des principes des 3R et aux changements réglementaires (par exemple, l'objectif de l'EPA de mettre fin aux tests sur les mammifères d'ici 2035). |
| Tests traditionnels sur les animaux | Mondial | 10,74 milliards USD (2019) | - | 2,64 % | 2028-2035 | Les prévisions indiquent une croissance légèrement accrue au cours de la période ultérieure, mais toujours nettement inférieure à celle des NMA. |
| Marché des modèles animaux | Mondial | 1,9 milliard USD (2022) | 3,6 milliards USD (2032) | 6,6 % | 2023-2032 | Cette prévision se concentre spécifiquement sur le marché des animaux eux-mêmes, affichant une croissance modérée, probablement stimulée par les besoins continus en R&D malgré la pression en faveur d'alternatives. |
Dans le même temps, le risque est grand pour les entreprises qui tardent à s'adapter. "Les investisseurs doivent être impitoyablement sélectifs", a déclaré un gestionnaire de fonds. "Ce n'est pas une marée montante. C'est un raz-de-marée. Certains bateaux vont monter. D'autres vont couler."
Une Révolution Silencieuse et Humaine
La décision de la FDA de mettre fin aux tests obligatoires sur les animaux pour les anticorps monoclonaux est plus qu'une mise à jour réglementaire. C'est le début discret d'une transformation biomédicale, qui promet des guérisons plus rapides, des prix de médicaments plus bas, une meilleure science et moins de cages.
Et pour les investisseurs les plus sophistiqués du monde, elle marque le début d'une nouvelle ère d'investissement - une ère qui récompense la prévoyance technologique, le leadership éthique et la science axée sur l'humain.
Dans un monde de bruit, les révolutions les plus significatives commencent parfois par le doux ronronnement d'une puce de silicium, qui remplace le couinement d'un rat de laboratoire.
